- RÉSERVES PHYSIOLOGIQUES - Réserves végétales
- RÉSERVES PHYSIOLOGIQUES - Réserves végétalesLa continuité de l’espèce chez les Végétaux supérieurs (Spermaphytes) est assurée par divers systèmes s’appuyant sur des structures dont la plus répandue et la mieux exploitée est la graine. Mais ce n’est pas le seul organe de conservation et de multiplication des plantes (tabl. 1). Tubercules, rhizomes, bulbes, hibernacles et turions concourent aussi à leur propagation. Dans un cas comme dans l’autre, les espèces prévoyantes emmagasinent des réserves qui seront mises à la disposition du nouvel organisme au moment de la germination. Il les utilisera jusqu’à son sevrage, c’est-à-dire lorsque, devenu autotrophe, le jeune individu assurera en toute indépendance son alimentation. Ces réserves sont destinées à fournir les éléments de base utiles aux nouvelles synthèses tout en libérant l’énergie nécessaire à la vie. C’est ainsi que dans la graine, le moment venu, l’embryon muni de ses réserves pourra prendre possession du milieu avec le maximum de chances de survie, sans autre secours que l’air et l’eau. Il affrontera donc avec une certaine garantie de succès les facteurs ambiants plus ou moins hostiles.L’emmagasinement des réserves ne se limite pas aux graines, aux fruits, aux tubercules et autres organes de multiplication et de dissémination. Les racines, les tiges, les feuilles peuvent également accumuler les métabolites en excès, ce stockage étant accompagné ou non d’hyperplasies et d’hypertrophies plus ou moins accusées des tissus (tabl. 1).1. Réserves liées à l’économie générale de la planteRéserves énergétiquesLes précurseurs des réserves sont au départ toujours des glucides, puisqu’ils sont synthétisés dans les parenchymes chlorophylliens. Les produits issus de la photosynthèse non utilisés par les feuilles migrent par voie libérienne vers des parenchymes de réserve où ils se déposeront généralement sous forme de glucides, plus rarement sous forme de lipides qui se constituent au détriment des glucides, ou encore de protides. C’est par exemple à partir des glucides solubles que se fabriquent les acides cétoniques qui permettront l’incorporation de l’azote et sa transformation en acides aminés.La mise en réserve dépend des cycles nycthéméral, saisonnier, annuel et selon des modalités propres aux divers organes qui seront donc examinés tour à tour.RacinesPrenons l’exemple de la betterave à sucre (Beta vulgaris ). La betterave est une plante bisannuelle. La première année, elle s’étale en une rosette de grandes feuilles tandis que s’accroît sa racine qui se charge de saccharose (de 15 à 20 p. 100 du poids frais). Au début de la journée, les limbes foliaires sont dépourvus d’amidon. Grâce à une photosynthèse active, un excès de glucides se constitue rapidement; ils s’accumuleront, sur place, sous forme d’amidon qui sera transformé en sucres réducteurs au cours de la nuit lorsque la photosynthèse aura cessé. D’autre part, pendant la période diurne elle-même, un flux (moins important cependant) est acheminé par la sève élaborée qui descend vers la racine pivotante, en passant par les pétioles des feuilles et la courte tige. En hiver, le pied entre en vie ralentie. La deuxième année, de nouvelles feuilles apparaissent. Les sucres qu’elles élaborent s’ajoutent aux réserves de la racine tubérisée qui s’épuisent pour assurer la croissance de la plante et la formation d’une tige qui portera en fin de végétation des semences bourrées de réserves. Il est évident que les agriculteurs effectueront la récolte au moment où les tubercules sont les plus riches en sucres.La chicorée (Cichorium intybus ), le dahlia entassent dans leurs racines, sous forme d’inuline, le mélange de saccharose, de glucose et de fructose élaboré dans leurs feuilles, glucides transportés par les vaisseaux du phloème. L’uridine diphosphate fructose participe à cette biosynthèse.Tiges et troncsLes substances de réserve peuvent s’accumuler dans des tiges souterraines (fécules de pomme de terre, crosne du Japon, cyclamens, ignames...) ou aériennes (saccharose de la canne à sucre, des sorghos sucriers...). Chez le maïs, plante annuelle, la tige aérienne épaisse se charge au cours de la phase végétative de matières nutritives qui sont consommées lors de la floraison et de la fructification. Pour les espèces bisannuelles, le scénario s’identifie à celui qui a déjà été décrit dans le cas de la betterave.Les arbres accumulent leurs réserves hydrocarbonées dans leurs troncs et dans leurs racines. La moelle de plusieurs palmiers (Metroxylon rumphii , M. sagu , Arenga ...) est exploitée pour en extraire du sagou (jusqu’à 400 kg par arbre), amidon qui leur est particulier. Chez les arbres à feuilles persistantes, l’accumulation est maximale en période de reprise active de la végétation, c’est-à-dire au printemps. Les teneurs sont les plus élevées chez les Corypha , palmiers hapaxanthes, juste avant la floraison unique et très profuse qui précède la mort de l’individu après soixante-dix ans de vie végétative. Chez les arbres à feuilles caduques, l’accumulation, d’une part, et la consommation, d’autre part, des produits de réserve se font en relation avec les périodes de vie active et de vie ralentie, elles-mêmes liées au rythme saisonnier; ainsi, c’est au moment de la chute des feuilles que les réserves seront le plus abondantes. Leur utilisation suivra, au printemps, la «montée de sève» qui réveille la vie végétative (elle fournit le sucre d’érable au Canada).Les processus métaboliques en jeu varient avec les espèces, avec le type de photosynthèse (C3, C4, CAM) et les conditions du milieu. La plante régularise son métabolisme et l’adaptera, dans certaines limites, aux circonstances. Cette homéostasie harmonise ses fonctions en rapport avec les facteurs ambiants et les facteurs internes. Dans tous ces phénomènes interviennent de nombreuses enzymes qui jalonnent les diverses étapes métaboliques. Le compartimentage intracellulaire complexe permet d’assurer une protection des systèmes métaboliques cellulaires. Cependant, certains stress induisent des changements enzymatiques. Ces modalités sont encore plus nettes quand il s’agit des réserves hydriques des végétaux.FeuillesLes feuilles peuvent contenir de forts pourcentages de protéines. L’une des plus importantes et des plus abondantes est la ribulose biphosphate carboxylase (RuBPCase) qui agit à la fois comme catalyseur et comme réserve. Elle représente de 40 à 80 p. 100 des protéines foliaires totales solubles du soja, de la luzerne, de la plupart des céréales. Elle est séquestrée dans les chloroplastes où elle se trouve protégée des protéases cytoplasmiques. Elle catalyse la fixation photosynthétique du C2 et intervient dans l’assimilation des nitrates. Ces protéines emmagasinées dans la feuille migrent vers la graine lors de la croissance de celle-ci.Les hautes teneurs en protéines des feuilles sont à la source d’une industrie de concentrés utilisés pour la nourriture du bétail; cette utilisation est envisagée pour l’alimentation des hommes dans les régions où les protéines animales font défaut.FruitsLe fruit est par excellence un organe d’emmagasinement de réserves. Celles-ci sont variées, mais, à maturité, ce sont les substances sucrées qui sont les plus abondantes et les plus courantes. Le raisin, la pomme, la poire, la banane, la châtaigne sont riches en glucides. Cependant, les transformations chimiques subies au cours de la croissance du fruit et de sa maturation sont complexes et différentes selon les espèces et variétés considérées et les conditions de développement.Les lipides sont d’ordinaire en faibles proportions. Toutefois, l’olive, l’avocat, le fruit du palmier à huile en renferment des quantités notables. En général, les lipides augmentent parallèlement à une diminution des glucides. D’autre part, R. Ulrich souligne que le fruit sur pied est le siège d’une accumulation de substances azotées, que la maturation est marquée par une active protéogenèse et que la sénescence est une phase de simplification moléculaire [cf. FRUITS].Réserves hydriquesUn type particulier de réserves se rencontre parmi les plantes adaptées aux régions arides et semi-arides qui accumulent d’abondantes quantités d’eau, qu’elles emploieront durant les périodes de sécheresse.Selon leur morphologie et leur physiologie, plusieurs catégories de plantes peuvent être distinguées:– Les arbres bouteille, dont le tronc épaissi est surmonté le plus souvent d’une malingre frondaison aux feuilles caduques. Ce tronc est constitué d’une forte proportion de tissus parenchymateux gorgés d’eau, souvent parcourus par des canaux, des cavités ou des cellules à mucilage. Le baobab, sorte d’immense éponge, peut emmagasiner plus de 120 000 litres d’eau, ce qui explique que les pasteurs du sud de Madagascar, lors des pénuries d’eau, les débitent pour «abreuver» leurs troupeaux. Les Bombacacées d’Amérique du Sud (Cavanillesa , Chorisia ...) bien adaptées à de rudes conditions de sécheresse ont d’inhabituels troncs en forme de baril, d’œuf ou de bouteille. Des espèces appartenant à d’autres familles présentent les mêmes possibilités d’emmagasinement (Adenium obsesum , Apocynacées, Moringa druardii , Moringacées, Adenia spp. , Passifloracées...).– Les succulentes (plantes grasses) aux épidermes à cuticule épaisse, qui emmagasinent l’eau dans les feuilles (Lithops ou plantes cailloux et autres Aizoacées, Agave , Aloe , Crassulacées...), les tiges (Stapelia , Euphorbia , Cactacées...) ou dans les racines et dans la région hypocotylaire (Pachypodium succulatum , Apocynacées).Ici aussi l’accumulation d’eau peut être considérable. Carnegia gigantea , Cactacée de l’Arizona, peut renfermer dans son appareil végétatif de 2 à 3 mètres cubes d’eau ou plus.Les plantes succulentes sont intéressantes parce qu’elles manifestent des interrelations entre leur organisation foliaire, leur physiologie et leur métabolisme. Elles les conduisent à conserver l’eau tout en ayant une photosynthèse maximale sous des conditions d’aridité. Cette dernière est de type CAM (métabolisme acide crassulacéen). D’une manière inaccoutumée, les stomates des plantes CAM sont ouverts la nuit de manière à absorber le C2 quand la transpiration est basse. Le C2 est fixé grâce à la phospho-énol-pyruvate-carboxylase et conservé dans les vacuoles des cellules foliaires sous forme de malate ou d’aspartate. Dans la journée, les stomates sont fermés, ce qui limite les pertes d’eau à la seule transpiration cuticulaire. D’autre part, le C2 est libéré et utilisé dans la synthèse glucidique selon la voie photosynthétique normale en C3.La plupart des plantes CAM modulent leur métabolisme d’après les conditions de l’environnement. Ainsi, leur fonctionnement varie selon que la saison des pluies ou la saison sèche sévissent, ou encore avec la durée de la photopériode. Les enzymes en jeu ne sont pas les mêmes en jours courts et en jours longs. D’autre part, la protection des propriétés membranaires est assurée par divers mécanismes, par exemple par la libération de simples sucres, de polyhydroxyalcools, de protéines. Les feuilles d’une même plante peuvent même appartenir à deux systèmes photosynthétiques différents selon leur position sur la plante et selon leur âge. Cela fait ressortir les remarquables qualités adaptatives et homéostasiques de nombreuses espèces.2. Réserves destinées à la reproductionLes organes de mise en réserve sont soit des organes spécialisés dans lesquels la plante mère dépose les métabolites en excès dont elle dispose, soit des graines issues de la fécondation des ovules par les grains de pollen. Dans un cas comme dans l’autre, la plante utilise des systèmes de protection et met des barrières (dormances) pour éviter que l’utilisation des matières nutritives se fasse mal à propos. Dans cette sorte de contrat d’assurance vie, destiné à réduire les faux départs à des époques inopportunes, interviennent des systèmes inhibiteurs qui cesseront d’intervenir lorsque les facteurs ambiants offriront une suffisante stabilité pour que la permanence de l’espèce soit assurée.Les organes de reproduction végétative sont des tubercules, des rhizomes ou des bulbes dans lesquels se trouvent généralement des parenchymes bourrés de produits résultant de la photosynthèse (le plus souvent l’amidon, glucide condensé mais rapidement mobilisable).Les tubercules de dahlia, de topinambour (Helianthus tuberosus ), ceux de nombreuses orchidées sont des racines renflées. Ceux de pomme de terre (Solanum tuberosum ) ou de crosne du Japon (Stachys tuberifera ) sont des rameaux souterrains auxquels participent plusieurs entrenœuds. Le tubercule de cyclamen n’est composé que d’un seul nœud hypertrophié.Les rhizomes sont des tiges souterraines vivaces, qui stockent les réserves permettant à l’individu d’affronter la mauvaise saison (exemple: sceau de Salomon = Polygonatum officinale , ou encore iris rhizomateux).Les bulbes sont formés par une tige très condensée, entourée de feuilles plus ou moins modifiées. Dans le cas des bulbes solides, la tige seule est épaissie, les feuilles sont minces et protectrices (colchique, glaïeul, safran, iris bulbeux). Les bulbes écailleux ont leurs feuilles relativement étroites; gonflées de matières de réserve, elles recouvrent une courte tige portant le point végétatif. Les feuilles des bulbes tuniqués sont au contraire très élargies, chacune entourant à peu près entièrement le bourgeon central et les écailles plus internes: ces dernières gorgées de matières nutritives et d’eau sont dites succulentes (oignon, jacinthe); les écailles externes, déshydratées, jouent un rôle protecteur.Les graines, toutes bâties selon un schéma général semblable, présentent néanmoins une grande disparité en ce qui concerne l’abondance et le type des réserves. Quand elles sont minuscules, et alors produites en quantités fabuleuses (plusieurs centaines de milliers dans une capsule d’orchidée), elles stockent peu de matériaux. Si elles sont volumineuses mais peu nombreuses (un fruit de palmier ou d’avocat ne renferme qu’une graine), elles accumulent d’abondantes réserves. En général, les grosses graines (type K) «à gestation lente» sont celles d’espèces pérennes, ligneuses, considérées comme primitives. Les petites graines (type r ), fabriquées plus rapidement, caractérisent des plantes surtout annuelles et herbacées (les symboles K et r sont empruntés aux équations décrivant la régulation de la dimension des populations).L’entreposage des réserves sera également très différent selon les espèces. Il se fera dans l’endosperme, tissu prothallien haploïde, chez les Gymnospermes. Chez les Angiospermes, les réserves se déposent soit dans le périsperme (tissu nucellaire diploïde d’origine maternelle), soit dans les cotylédons (la plupart des Légumineuses, les Crucifères...) ou l’axe hypocotylaire (Bertholetia excelsa , ou noix du Brésil), soit encore dans l’albumen, tissu triploïde issu de la double fécondation et spécialisé dans l’accumulation des réserves (graminées, ricin...).3. Métabolisme des substances de réserveRéserves lipidiquesLes lipides ou corps gras sont emmagasinés dans les cotylédons, l’albumen, plus rarement dans le périsperme ou l’axe hypocotylé ou encore dans le mésocarpe du fruit (olive, palmier à huile); les plantes dites oléagineuses en renferment ainsi de grandes quantités (tabl. 1).Les teneurs en matières grasses sont sujettes à variation, étant influencées par les facteurs saisonniers et géographiques, d’une part, et par les facteurs génétiques, d’autre part.Les triacylglycérides (triesters du glycérol et acides gras) représentent les réserves habituelles des plantes. Cinq acides gras y prédominent. Ce sont les acides insaturés, oléique (C18:1), linoléique (C18:2), linolénique (C18:3), ou saturés, palmitique (C16:0) et stéarique (C18:0). Il existe d’autres acides gras chez les végétaux: acides caproïque (C6), caprilique (C8), caprique (C10) présents dans l’huile de palme et de coprah, acide laurique (C12) des huiles de coprah, de palme et de laurier; l’acide ricinoléique (C18) de l’huile de ricin ; l’acide arachidique (C20) de l’huile d’arachide et l’acide érucique (C22) de l’huile de colza (anciennes variétés). Ces quelques exemples montrent la grande diversité de composition des matières grasses des plantes oléagineuses. Deux huiles provenant d’organes différents de la même espèce peuvent avoir des compositions dissemblables (cas du palmier à huile).Les galactolipides et les phospholipides entrent ordinairement dans la constitution des membranes, surtout des organites cellulaires. Néanmoins, ils peuvent être abondants dans les réserves lipidiques des graines: 78 p. 100 des lipides totaux chez Briza spicata (Smith et Wolff, 1964).La maturation des graines oléagineuses se réalise en trois étapes:– Au cours de la phase initiale (selon les espèces, de 10 à 25 jours après la pollinisation de l’ovule), les divisions cellulaires sont actives. La synthèse des lipides est nulle. En revanche, des glucides se forment, qui seront transformés ultérieurement en acides gras.– La phase suivante (de 20 à 30 jours) est marquée par une élongation et un élargissement des cellules et par une synthèse poussée des acides gras. Plus de 90 p. 100 des réserves lipidiques sont mis en place à l’issue de cette période. Chez le colza, l’acide linoléique formé au début n’augmente plus; en outre, il y a une extraordinaire élévation des quantités d’acide érucique. Chez le ricin, la formation d’acide linoléique très timide s’arrête vite, les acides oléique, palmitique augmentent graduellement, mais c’est essentiellement l’acide ricinoléique qui est emmagasiné.– Au cours de la phase finale, le dépôt des triglycérides est stoppé; cet arrêt est accompagné de la déshydratation de la graine qui se poursuivra jusqu’à sa dessiccation complète à maturité.La composition des corps gras mis en réserve dépend de plusieurs facteurs.La température a une action manifeste mais plus ou moins marquée selon l’espèce considérée (ou même le cultivar). Les huiles des plantes croissant en régions tempérées ou fraîches seraient plus riches en acides gras insaturés que celles des régions chaudes. Chez le lin, le tournesol, l’acide linoléique diminue, l’acide oléique augmente quand la température passe de 10 à 20 ou à 30 0C. La lumière affecterait également la composition en acides gras, surtout chez les graines à testa translucide.Les facteurs génétiques jouent un rôle prépondérant, ce qui a été bien mis en évidence chez le colza. L’huile de colza est normalement riche en acide érucique, soupçonné d’action néfaste sur le myocarde. Mais la sélection a permis d’isoler des lignées sans acide érucique, donc non dangereuses. L’étude des 2 et des 3 fait penser que le contrôle est sous la dépendance de deux gènes.La synthèse des triacylglycérols est réalisée à partir d’hydrates de carbone, de petites molécules qui en dérivent, de glycérides déjà existants qui peuvent être modifiés en échangeant leurs acides gras pour d’autres, nés d’autres «pools» de la cellule [cf. LIPIDES].Au cours de la germination, la dégradation des triacylglycérols se fait par l’intermédiaire des lipases qui vont catalyser leur clivage en rompant les ponts esters. Acides gras et glycérol seront libérés selon un processus semblable mais inverse de celui que l’on observe pour la synthèse de triglycérides.Le glycérol, à la suite de phosphorylations et d’oxydations et par la voie glycolytique, donne des trioses phosphates qui peuvent être convertis en pyruvates ou être plus généralement condensés par l’aldolase pour produire des hexoses (fructose diphosphate en particulier). Les acides gras peuvent être dégradés par des réactions d’oxydation dans lesquelles ATP et CoA sont impliqués. À chaque étape séquentielle, deux atomes de carbone sont enlevés.Les lipides insolubles seront ainsi transformés en glucides, c’est-à-dire en matière nutritive capable de circuler dans la plante sous forme dissoute. Les mesures de quotient respiratoire reflètent ces modifications métaboliques. En effet, les QR de la graine entière sont bas (de 0,30 à 0,48 selon l’âge de la plantule); en revanche, dans l’embryon, ils sont proches de l’unité, ce qui indique une consommation massive des glucides libérés en relation avec les exigences énergétiques de la jeune plantule. Les matières grasses servent donc à la fois de réserves énergétiques et de réserves carbonées.Leur situation intracellulaire est démontrée par l’examen microscopique des cellules d’une graine oléagineuse mûre qui montre de fines gouttelettes sphériques (de 0,2 à 6 猪m de diamètre) en suspension dans le cytoplasme. Colorables en rouge par le Soudan III, en noir par l’acide osmique, elles sont appelées vésicules lipidiques, corps lipidiques, gouttelettes lipidiques, sphérosomes, oléosomes. Leur origine reste controversée.Une première hypothèse, émise par Frey-Wissling et ses collaborateurs (1963), appuyée par Schwarzenbach (1971), par Wanner et ses collaborateurs en 1981 et d’autres auteurs, consiste à penser que les vésicules lipidiques dérivent de sphérosomes détachés de l’extrémité du réticulum endoplasmique (fig. 1). L’huile s’accumulerait entre les deux feuillets de la membrane, dont seul l’externe subsisterait. L’équipement enzymatique de départ assure la synthèse à partir de nutriments venant de l’extérieur de la gouttelette.D’autres auteurs (Sorokin, 1967, Smith, 1974) estiment que sphérosomes et corps lipidiques constituent des entités différentes, les seconds se distinguant des premiers par l’absence d’une membrane limitante; cependant, le caractère osmiophile des lipides et de la membrane rend difficile l’observation de celleci. Mais les enzymes ne seraient pas les mêmes dans les deux types d’organites. Les sphérosomes, riches en phospholipides et protéines, donneraient naissance aux vacuoles dans lesquelles se forment les grains d’aleurone, les vésicules biosynthétiseraient les huiles.L’utilisation des lipides par la graine en germination met en jeu les corps lipidiques, les glyoxysomes, les mitochondries (fig. 2).La lipolyse se réalise dans les vésicules lipidiques. Chez le ricin, elle se déclenche trois jours après l’imbibition de la graine et s’achève sept jours plus tard quand l’albumen est complètement digéré. Tout d’abord, une lipase acide (pH=5) localisée dans les corps lipidiques hydrolyse les triglycérols, les diglycérols et les monoglycérols. Ensuite, une lipase alcaline (pH=9) située dans les glyoxysomes intervient.L’oxydation des acides gras et la synthèse des succinates via le cycle glyoxylique s’effectuent dans les glyoxysomes. La transformation des succinates en oxaloacétates est sous la dépendance des mitochondries. Finalement, les oxaloacétates sont convertis en hexoses dans le cytoplasme. Quant au glycérol, il est phosphorylé par une glycérol kinase pour donner des glycérophosphates qui, oxydés dans les mitochondries, seront ensuite libérés dans le cytosol et convertis en hexoses puis en saccharose qui migrera vers l’axe embryonnaire.Les glyoxysomes sont des organites discrets (de 0,2 à 1,5 猪m de diamètre) contenant l’assortiment complet des enzymes entrant dans le cycle glyoxylique notamment les deux enzymes clés de ce cycle: l’isocitrate lyase et la malate synthétase. Limités par une membrane simple, ils apparaissent dès le début de la germination. Étroitement associés aux corps lipidiques et aux mitochondries pour gouverner la transformation des lipides en sucres (gluconéogenèse), ils alimenteront ainsi la respiration mitochondriale.Chez les Monocotylédones, le processus catabolique est quelque peu différent. Par exemple, l’haustorium d’Elaeis guineensis vide l’albumen dont les produits sont dirigés vers la plantule en voie de développement à moins qu’ils ne demeurent transitoirement dans le suçoir.Réserves protéiniquesLes protéines de graines n’étant identifiables qu’après extraction, elles ont été classées (classification d’Osborne) selon leurs caractères de solubilité dans divers solvants, en quatre groupes principaux, eux-mêmes hétérogènes:– les albumines , solubles dans l’eau à pH 7 ou légèrement acides et coagulables aisément par la chaleur;– les globulines , insolubles dans l’eau mais se dissolvant dans des solutions salines; elles ne sont pas aussi facilement coagulables par la chaleur que les précédentes;– les glutélines , extraites par des solutions fortement alcalines (KOH);– les prolamines , solubles dans l’éthanol.Les albumines sont des protéines de structure ou des enzymes jouant un rôle important dans le métabolisme; globulines, glutélines et prolamines sont surtout des protéines de réserve.Protéines des grains de céréaleLe caryopse des céréales est composé d’un albumen (90 p. 100 du poids sec du grain), d’un embryon (5 p. 100 du poids sec), des téguments de la graine (testa) et du fruit (péricarpe) qui constituent les 5 p. 100 restants. L’albumen se développe plus rapidement que l’embryon. De 12 à 14 jours après la fécondation, alors qu’il passe de l’état liquide à l’état cellulaire, la synthèse de l’amidon et des protéines s’accroît fortement. Les protéines de réserve s’accumulent dans l’albumen, plus spécialement dans sa couche ou ses couches les plus externes auxquelles on a donné le nom d’assise à aleurone: leurs cellules renferment de petits grains d’amidon et d’abondants corps protéiques appelés autrefois grains d’aleurone.Mélange complexe, les albumines sont composées en grande partie d’enzymes intervenant dans le métabolisme lors du développement du grain. Elles se maintiennent après la déshydratation consécutive à la maturation du grain. À la germination, elles sont responsables de la mobilisation des réserves (amidon, protéines, phytine). Les globulines, très similaires à celles des Légumineuses, sont principalement concentrées dans l’embryon. Les prolamines tirent leur nom – par contraction – des deux acides majeurs qui les composent: la proline et la glutamine. Elles ont reçu des appellations en rapport avec la céréale d’où elles sont tirées (tabl. 2). Leur composition en acides aminés révèle une déficience en lysine et en tryptophane. Les glutélines sont composées de trois sous-unités maintenues par des ponts disulfure, ce qui expliquerait leur forte insolubilité et la difficulté de les caractériser.Le gluten des blés, complexe protéinique formé de gliadine (prolamine) et de gluténine (glutéline), est responsable des qualités boulangères de leurs farines. L’hétérogénéité des gliadines est utilisée commercialement pour l’identification des cultivars (Autran et Bourdet, 1975).Les progrès techniques: microscopie électronique, fractionnement cellulaire, marquage des acides aminés, synthèse in vitro des protéines, ont permis de suivre l’ontogénie de la maturation des caryopses. Chez le maïs, et le schéma est valable pour la plupart des autres céréales, les étapes du développement de l’albumen peuvent être ainsi résumées.Tout d’abord, l’activité mitotique est forte. L’albumen est liquide puis il se cloisonne. Les mitoses cessent. Suit une phase d’élongation et d’élargissement des cellules. Le réticulum endoplasmique rugueux et les polyribosomes prolifèrent. Les corps protéiques et les grains d’aleurone (ceux-ci riches en phytine et en enzymes hydrolytiques sont localisés dans les couches périphériques) apparaissent et se multiplient sensiblement en même temps que les grains d’amidon. Albumines et globulines sont les premières protéines détectées, puis les glutélines sont synthétisées principalement semble-t-il entre le 15e et le 25e jour. La biosynthèse des protéines reprend intensément pour cesser avec le dessèchement du grain. Les prolamines sont formées le plus tardivement mais en grande quantité. Le poids sec des caryopses augmente jusqu’à complète maturation (taux d’humidité entre 10 et 12 p. 100). Le poids frais, d’abord croissant, diminue vers le 30e-35e jour qui suit l’anthèse. ARN et acides aminés sont au maximum à peu près au même moment, tandis que, si les ADN déclinent dans l’albumen, ils augmentent dans l’embryon.Chez le riz, les glutélines représentent plus de 80 p. 100 des protéines et les prolamines seulement 5 p. 100. L’accumulation des premières domine tout au long de la formation du grain.Protéines des LégumineusesLes Légumineuses déposent leurs réserves dans les cotylédons. L’albumen, d’abord liquide puis cellulaire, est vite consommé par l’embryon. Son absorption toutefois n’est pas totale chez la caroube, le fenugrec et quelques autres espèces. La mise en place des réserves débute avec la phase d’élongation cellulaire et se poursuit jusqu’à maturation de la graine.Les graines de Légumineuses contiennent de 20 à 55 p. 100 de protéines dont la majorité (de 60 à 80 p. 100) est représentée par des globulines qui sont essentiellement des protéines de réserve. Elles sont composées de deux fractions formées elles-mêmes de sous-unités:– la légumine , de haut poids moléculaire (env. 5 544 憐 10-18 grammes), qui précipite dans les solutions salines à son point isoélectrique (pH 4,8), ne coagule pas aux hautes températures (100 0C) et dont la constante de sédimentation est de 11-12 S;– la viciline , de poids moléculaire environ 3 108 憐 1-20 grammes, qui est plus soluble que la légumine; son point isoélectrique se trouve à pH 5,5; elle est stable à pH 5; elle coagule à 95 0C et son coefficient de sédimentation est de 7 S.Ces deux types de globulines, qui se retrouvent chez la plupart des Légumineuses mais en proportions variables, révèlent une déficience générale en acides aminés soufrés: méthionine et cyst(é)ine vitaux pour l’homme et les animaux monogastriques.Si nous considérons le développement de la graine de haricot, nous y distinguons plusieurs stades (fig. 3).Ce n’est qu’au stade 4 (19e-22e jour) qu’une pause a lieu dans l’élongation cellulaire et la croissance. Elle correspond à une importante réplication de l’ADN des cellules et à une forte prolifération du réticulum endoplasmique granuleux et des polysomes et à la formation de nombreuses petites vacuoles. Le spectre des activités isoenzymatiques se modifie. La synthèse des réserves, amidon puis protéines, démarre.Au stade 5 (23e-32e jour), les vacuoles se transforment en corps protéiques et la synthèse se poursuit activement. Les gouttelettes lipidiques se multiplient. Albumines et surtout globulines se déposent alors que baisse le pool des acides aminés.Vient enfin le stade 6 . Au-delà du 32e-35e jour, phase de déshydratation progressive: le réticulum des cellules se raréfie puis disparaît; les corps protéiques, denses aux électrons, s’arrondissent; les vésicules lipidiques s’alignent le long des parois et autour des grains d’amidon.Au total, les protéines de réserve sont déposées dans des organites dénommés corps protéiques , tels ceux qui sont situés dans les cotylédons qui stockent des globulines, ou grains d’aleurone , tels ceux des assises périphériques de l’albumen qui accumulent alors des prolamines. Ils auraient une double origine: vacuoles d’une part, vésicules terminales du réticulum granuleux d’autre part (Tourmel-Prévosti, 1979).Les corps protéiques de la plupart des Légumineuses sont apparemment homogènes alors que les grains d’aleurone des Graminées contiennent une ou plusieurs inclusions, les globoïdes riches en phytine (hexaphospho-inositol). Dans les grains d’aleurone de ricin coexistent un ou deux globoïdes et un cristalloïde, assemblage cristallisé, au contour polygonal, de protéines et d’hydrates de carbone. L’aleurone renferme aussi une lectine très toxique, la ricine .Dans les corps protéiques apparaissent, en même temps que les globulines, des protéases qui interviendraient dans le remaniement du contenu vacuolaire lors de la maturation et dans leur dégradation au moment de la germination. Des inhibiteurs de protéase ont également été décelés, ils sont probablement stockés dans les mêmes structures. Ils permettraient de bloquer l’action des protéases en attendant la levée d’inhibition qui se produirait à la germination. Cette explication rendrait moins énigmatique la présence de protéases au sein des globulines. Néanmoins, la présence et le rôle de ces inhibiteurs comme régulateurs de protéolyse demeurent obscurs. Le problème du compartimentage cellulaire est également loin d’être totalement éclairci.Pour scinder les protéines en molécules plus simples lors de la germination, deux voies de protéolyse semblent possibles:
 Ces produits seront transloqués de l’albumen ou des cotylédons vers l’axe embryonnaire. Ils serviront à l’édification des nouveaux matériaux utilisés par la plantule en croissance. Les acides aminés, après désamination et oxydation de leur squelette carboné, fourniront également l’énergie nécessaire. L’ammoniaque résultant de ces réactions est fixé sous forme de glutamine et d’asparagine, ce qui évite son accumulation à des niveaux toxiques. L’activité enzymatique en jeu paraît plutôt résulter de protéases encloses dans les corps protéiques depuis la maturation que provenir de synthèses nouvelles. La digestion des corps protéiques, tant chez les Monocotylédones que chez les Dicotylédones, s’accompagne de leur transformation en vacuoles qui fusionnent en une grande vacuole selon un processus inverse de celui qu’on observe le long de la maturation (fig. 4).Chez le pois, le transfert des acides aminés commence dès le 2e ou 3e jour et se poursuit jusqu’à la désintégration des cotylédons. Les amino-acides, dont le taux augmente le plus au cours de la protéolyse, sont l’acide glutamique et l’acide aspartique, principaux acides aminés de la viciline et de la légumine, également l’homosérine, acide aminé libre, donc non incorporé à une protéine. L’acide aspartique est convertible en homosérine, laquelle serait la principale forme de transport d’acides aminés des cotylédons vers l’axe. Chez le ricin (Dicotylédone), la protéolyse est comparable à celle qui est observée dans les caryopses de céréales et principalement de maïs (Monocotylédone). La forme principale de transport serait la glutamine; toutefois, en fournissant aspartate, glutamate, alanine, glycine et sérine marqués, on a constaté leur conversion en saccharose qui migre ensuite vers la plantule.Réserves glucidiquesLes hydrates de carbone ou glucides représentent de 50 à 80 p. 100 du poids sec des caryopses de Graminées, où ils sont confinés dans la partie centrale de l’albumen, et de celles de plusieurs Légumineuses, où ils sont déposés dans les cotylédons et parfois aussi dans l’axe embryonnaire. Les tubercules en contiennent des quantités notables. Quelques espèces, comme le ricin, n’en fabriquent pas (tabl. 1).Les réserves glucidiques sont des osides: diholosides, oligosides et polyosides.Les diholosides ou disaccharides: entrent dans cette catégorie les sucres qui répondent à la formule brute C12H2211. À l’hydrolyse, cette molécule se scinde en deux hexoses C6H126. Les principaux de ces sucres sont le saccharose et le maltose.Le saccharose est un dioside non réducteur, très soluble dans l’eau, fortement dextrogyre; il se trouve à l’état dissous dans le suc vacuolaire des cellules de la moelle des tiges de canne à sucre (de 18 à 20 p. 100) ou de sorgho sucrier (12 p. 100), des racines tubérisées de betterave (15 p. 100). La sève de l’érable à sucre en contient jusqu’à 25 p. 100, ainsi que l’embryon de blé et certaines lignées de maïs.Le saccharose, synthétisé à partir de monosaccharides issus de la photosynthèse, peut provenir aussi de la dégradation de l’amidon par digestion amylolytique, ou encore dériver de la gluconéogenèse par conversion des lipides et des protéines. Inversement, c’est un élément essentiel de la biosynthèse de ces produits. Hydrolysé, il se scinde en un aldose dextrogyre ( 見-glucose) et en un cétose lévogyre (fructose) qui existent à l’état libre dans beaucoup de fruits (datte, de 24 à 50 p. 100).Le maltose est un dioside réducteur, très soluble dans l’eau. Il n’existe que rarement à l’état de réserve: Umbilicus , Mercurialis , Lathyrus . C’est surtout une forme de passage temporairement abondante dans les jeunes plantules provenant de graines amylacées au cours de l’hydrolyse enzymatique de l’amidon dont il est le dimère constitutif; il produit ensuite deux molécules de glucose 見.Les oligosides comptent de 3 à 6 oses. Dans ce groupe sont à citer: le raffinose, associé au saccharose dans les racines de betterave, et le stachyose qui les accompagne dans les tubercules du crosne du Japon, les graines de lupin, de soja, de lentille. Ces sucres jouent un rôle important dans la résistance des plantes au froid. En hiver, leur teneur augmente simultanément à une baisse de l’amidon.Les polyosides=polysaccharides sont composés d’un nombre d’oses supérieur à huit. Ce sont des constituants des membranes (mannanes, cellulose) ou des réserves cytoplasmiques (amidon, inuline).L’amidon est le principal polyoside de réserve des végétaux chlorophylliens: les graines en contiennent jusqu’à 80 p. 100 de leur poids frais, et les tubercules et bulbes jusqu’à 30 p. 100. Ce polysaccharide, de formule globale (C6H105)n , où n est très élevé (de 200 à plus de 1 000), est colorable en bleu violacé – réaction de lugol – par les réactifs iodés (iodo-iodure de potassium). Il se présente sous forme de grains simples (haricot, blé) ou composés (riz, avoine) de forme sphérique, lenticulaire, anguleuse et de taille (de 2 à 175 猪m) caractéristiques de chaque espèce (fig. 5). La forme dépend des proportions d’amylose du grain, les grains arrondis en ayant un contenu plus élevé que les angulaires. La distribution des populations de grains, généralement unimodale quant aux dimensions, peut être bimodale comme chez le blé, l’orge, Dioscorea esculenta (igname).Généralement, les grains sont marqués de stries concentriques autour d’un hile central ou excentré. Le hile correspond à la première ébauche du grain, et les stries représentent les couches qui se sont apposées au cours de la croissance discontinue du grain liée au rythme jour-nuit.La disposition régulière des couches entraîne une biréfringence qui donne lieu au phénomène de la croix noire en lumière polarisée, traduisant l’existence d’une orientation moléculaire à l’intérieur du grain.Les grains d’amidon insolubles dans l’eau froide donnent, lorsqu’ils sont traités par l’eau chaude (de 60 à 80 0C), un empois, liquide visqueux qui durcit en séchant. Ils renferment une matière mucilagineuse (amylopectine ) à laquelle est due la viscosité de l’empois et de l’amylose , substance en solution fluide qui précipite après refroidissement sous forme d’une poudre blanche (rétrogradation de l’empois). Ce sont deux polysaccharides de configuration moléculaire différente (fig. 6).Mais la composition d’un grain est en réalité complexe. Tout d’abord, il comprend de 15 à 20 p. 100 d’eau, mais aussi des acides gras (1 p. 100 chez le blé), des phosphates de calcium (céréales) et de potassium (pomme de terre) faisant partie d’un résidu minéral qui peut représenter 0,4 p. 100 du poids frais (amidon de blé), enfin des protéines dont la plupart sont enzymatiques. Cette composition varie avec les espèces; elle correspond à la diversité morphologique déjà signalée.L’hydrolyse, par les acides minéraux ou par les amylases, provoque le clivage de l’amidon en fragments solubles dans l’eau (dextrines ), colorables par l’iode en violet (amylodextrines ) ou en rouge vineux (érythrodextrines ). Les derniers stades de l’hydrolyse conduisent à la formation de maltose et enfin de glucose.Dans la biosynthèse de l’amidon, le saccharose est le point de départ. Les réactions ci-contre, pour la plupart réversibles (fig. 7), sont impliquées (Bewley et Black, 1978).L’incorporation d’UDP ou d’ADP a été suivie en les marquant avec du 14C (pomme de terre, riz, haricot). Le glucose de l’ADPG est ajouté à un accepteur, ce qui augmente la longueur de la chaîne d’une unité. Cette adjonction se poursuit jusqu’à ce que la molécule d’amylose soit complète, puis intervient l’enzyme Q, une transglucosidase, qui assure les branchements 1-6 et construit les amylopectines. Les donneurs de glucosides sont de longues chaînes réalisées par les moyens précédents, selon le modèle ci-dessous:
Ces produits seront transloqués de l’albumen ou des cotylédons vers l’axe embryonnaire. Ils serviront à l’édification des nouveaux matériaux utilisés par la plantule en croissance. Les acides aminés, après désamination et oxydation de leur squelette carboné, fourniront également l’énergie nécessaire. L’ammoniaque résultant de ces réactions est fixé sous forme de glutamine et d’asparagine, ce qui évite son accumulation à des niveaux toxiques. L’activité enzymatique en jeu paraît plutôt résulter de protéases encloses dans les corps protéiques depuis la maturation que provenir de synthèses nouvelles. La digestion des corps protéiques, tant chez les Monocotylédones que chez les Dicotylédones, s’accompagne de leur transformation en vacuoles qui fusionnent en une grande vacuole selon un processus inverse de celui qu’on observe le long de la maturation (fig. 4).Chez le pois, le transfert des acides aminés commence dès le 2e ou 3e jour et se poursuit jusqu’à la désintégration des cotylédons. Les amino-acides, dont le taux augmente le plus au cours de la protéolyse, sont l’acide glutamique et l’acide aspartique, principaux acides aminés de la viciline et de la légumine, également l’homosérine, acide aminé libre, donc non incorporé à une protéine. L’acide aspartique est convertible en homosérine, laquelle serait la principale forme de transport d’acides aminés des cotylédons vers l’axe. Chez le ricin (Dicotylédone), la protéolyse est comparable à celle qui est observée dans les caryopses de céréales et principalement de maïs (Monocotylédone). La forme principale de transport serait la glutamine; toutefois, en fournissant aspartate, glutamate, alanine, glycine et sérine marqués, on a constaté leur conversion en saccharose qui migre ensuite vers la plantule.Réserves glucidiquesLes hydrates de carbone ou glucides représentent de 50 à 80 p. 100 du poids sec des caryopses de Graminées, où ils sont confinés dans la partie centrale de l’albumen, et de celles de plusieurs Légumineuses, où ils sont déposés dans les cotylédons et parfois aussi dans l’axe embryonnaire. Les tubercules en contiennent des quantités notables. Quelques espèces, comme le ricin, n’en fabriquent pas (tabl. 1).Les réserves glucidiques sont des osides: diholosides, oligosides et polyosides.Les diholosides ou disaccharides: entrent dans cette catégorie les sucres qui répondent à la formule brute C12H2211. À l’hydrolyse, cette molécule se scinde en deux hexoses C6H126. Les principaux de ces sucres sont le saccharose et le maltose.Le saccharose est un dioside non réducteur, très soluble dans l’eau, fortement dextrogyre; il se trouve à l’état dissous dans le suc vacuolaire des cellules de la moelle des tiges de canne à sucre (de 18 à 20 p. 100) ou de sorgho sucrier (12 p. 100), des racines tubérisées de betterave (15 p. 100). La sève de l’érable à sucre en contient jusqu’à 25 p. 100, ainsi que l’embryon de blé et certaines lignées de maïs.Le saccharose, synthétisé à partir de monosaccharides issus de la photosynthèse, peut provenir aussi de la dégradation de l’amidon par digestion amylolytique, ou encore dériver de la gluconéogenèse par conversion des lipides et des protéines. Inversement, c’est un élément essentiel de la biosynthèse de ces produits. Hydrolysé, il se scinde en un aldose dextrogyre ( 見-glucose) et en un cétose lévogyre (fructose) qui existent à l’état libre dans beaucoup de fruits (datte, de 24 à 50 p. 100).Le maltose est un dioside réducteur, très soluble dans l’eau. Il n’existe que rarement à l’état de réserve: Umbilicus , Mercurialis , Lathyrus . C’est surtout une forme de passage temporairement abondante dans les jeunes plantules provenant de graines amylacées au cours de l’hydrolyse enzymatique de l’amidon dont il est le dimère constitutif; il produit ensuite deux molécules de glucose 見.Les oligosides comptent de 3 à 6 oses. Dans ce groupe sont à citer: le raffinose, associé au saccharose dans les racines de betterave, et le stachyose qui les accompagne dans les tubercules du crosne du Japon, les graines de lupin, de soja, de lentille. Ces sucres jouent un rôle important dans la résistance des plantes au froid. En hiver, leur teneur augmente simultanément à une baisse de l’amidon.Les polyosides=polysaccharides sont composés d’un nombre d’oses supérieur à huit. Ce sont des constituants des membranes (mannanes, cellulose) ou des réserves cytoplasmiques (amidon, inuline).L’amidon est le principal polyoside de réserve des végétaux chlorophylliens: les graines en contiennent jusqu’à 80 p. 100 de leur poids frais, et les tubercules et bulbes jusqu’à 30 p. 100. Ce polysaccharide, de formule globale (C6H105)n , où n est très élevé (de 200 à plus de 1 000), est colorable en bleu violacé – réaction de lugol – par les réactifs iodés (iodo-iodure de potassium). Il se présente sous forme de grains simples (haricot, blé) ou composés (riz, avoine) de forme sphérique, lenticulaire, anguleuse et de taille (de 2 à 175 猪m) caractéristiques de chaque espèce (fig. 5). La forme dépend des proportions d’amylose du grain, les grains arrondis en ayant un contenu plus élevé que les angulaires. La distribution des populations de grains, généralement unimodale quant aux dimensions, peut être bimodale comme chez le blé, l’orge, Dioscorea esculenta (igname).Généralement, les grains sont marqués de stries concentriques autour d’un hile central ou excentré. Le hile correspond à la première ébauche du grain, et les stries représentent les couches qui se sont apposées au cours de la croissance discontinue du grain liée au rythme jour-nuit.La disposition régulière des couches entraîne une biréfringence qui donne lieu au phénomène de la croix noire en lumière polarisée, traduisant l’existence d’une orientation moléculaire à l’intérieur du grain.Les grains d’amidon insolubles dans l’eau froide donnent, lorsqu’ils sont traités par l’eau chaude (de 60 à 80 0C), un empois, liquide visqueux qui durcit en séchant. Ils renferment une matière mucilagineuse (amylopectine ) à laquelle est due la viscosité de l’empois et de l’amylose , substance en solution fluide qui précipite après refroidissement sous forme d’une poudre blanche (rétrogradation de l’empois). Ce sont deux polysaccharides de configuration moléculaire différente (fig. 6).Mais la composition d’un grain est en réalité complexe. Tout d’abord, il comprend de 15 à 20 p. 100 d’eau, mais aussi des acides gras (1 p. 100 chez le blé), des phosphates de calcium (céréales) et de potassium (pomme de terre) faisant partie d’un résidu minéral qui peut représenter 0,4 p. 100 du poids frais (amidon de blé), enfin des protéines dont la plupart sont enzymatiques. Cette composition varie avec les espèces; elle correspond à la diversité morphologique déjà signalée.L’hydrolyse, par les acides minéraux ou par les amylases, provoque le clivage de l’amidon en fragments solubles dans l’eau (dextrines ), colorables par l’iode en violet (amylodextrines ) ou en rouge vineux (érythrodextrines ). Les derniers stades de l’hydrolyse conduisent à la formation de maltose et enfin de glucose.Dans la biosynthèse de l’amidon, le saccharose est le point de départ. Les réactions ci-contre, pour la plupart réversibles (fig. 7), sont impliquées (Bewley et Black, 1978).L’incorporation d’UDP ou d’ADP a été suivie en les marquant avec du 14C (pomme de terre, riz, haricot). Le glucose de l’ADPG est ajouté à un accepteur, ce qui augmente la longueur de la chaîne d’une unité. Cette adjonction se poursuit jusqu’à ce que la molécule d’amylose soit complète, puis intervient l’enzyme Q, une transglucosidase, qui assure les branchements 1-6 et construit les amylopectines. Les donneurs de glucosides sont de longues chaînes réalisées par les moyens précédents, selon le modèle ci-dessous: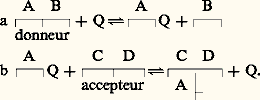 Cette enzyme a été trouvée chez la pomme de terre, le haricot. Deux voies cataboliques sont connues dans la dégradation de l’amidon: l’une est hydrolytique et fait intervenir les amylases 見 et 廓. Les 見-amylases agissent en transformant l’amylose en glucose et en 見-maltose, l’amylopectine en glucose, 見-maltose et dextrine limite 見. Les 廓-amylases produisent, à partir de l’amylose, du 廓-maltose (d’où son nom) et à partir des amylopectines du 廓-maltose et des dextrines limites 廓.Les amylases ne coupent les molécules qu’au niveau des liaisons 1-4; elles sont incapables d’ouvrir les liaisons 1-6. Il reste des noyaux très ramifiés d’unités glucose appelés dextrines limites. C’est une amylo 1-6 glucosidase, encore appelée enzyme R, qui a la possibilité de rompre les ramifications latérales de l’amylopectine ou des dextrines limites. Une maltase (l’ 見-glucosidase) est susceptible de transformer l’ 見-maltose en glucose.L’autre voie catabolique met en action une amylophosphorylase. Elle libère, en présence de phosphore inorganique, du glucose 1-P et des dextrines limites. Elle a été trouvée chez la pomme de terre, le maïs, le pois sous forme de plusieurs isomères.L’inuline est un fructoholoside composé de 30-40 restes fructose. Hydrolysée par des inulases, cette chaîne se rompt au niveau des liaisons 2-1 en produisant exclusivement des fructoses à l’exception des terminaisons glucose de la molécule.L’inuline est condensée, à partir des sucres provenant des feuilles, dans les organes souterrains (topinambour, dahlia, chicorée) ou les réceptacles floraux (artichaut). Elle existe à l’état dissous dans les vacuoles où elle précipite par l’action d’alcool absolu sous forme de sphérocristaux, non colorables par l’iode et qui se déposent le long des parois cellulaires. Elle est présente chez les Composées, les Campanulacées, les Lobéliacées. Des substances apparentées à l’inuline se rencontrent chez les Liliacées, les Amaryllidacées, les Graminées (le nombre de restes est moindre).Les mannanes sont des polymères de résidus mannose liés en 1-4. Ils forment une chaîne sur laquelle sont attachés de loin en loin des galactoses:
Cette enzyme a été trouvée chez la pomme de terre, le haricot. Deux voies cataboliques sont connues dans la dégradation de l’amidon: l’une est hydrolytique et fait intervenir les amylases 見 et 廓. Les 見-amylases agissent en transformant l’amylose en glucose et en 見-maltose, l’amylopectine en glucose, 見-maltose et dextrine limite 見. Les 廓-amylases produisent, à partir de l’amylose, du 廓-maltose (d’où son nom) et à partir des amylopectines du 廓-maltose et des dextrines limites 廓.Les amylases ne coupent les molécules qu’au niveau des liaisons 1-4; elles sont incapables d’ouvrir les liaisons 1-6. Il reste des noyaux très ramifiés d’unités glucose appelés dextrines limites. C’est une amylo 1-6 glucosidase, encore appelée enzyme R, qui a la possibilité de rompre les ramifications latérales de l’amylopectine ou des dextrines limites. Une maltase (l’ 見-glucosidase) est susceptible de transformer l’ 見-maltose en glucose.L’autre voie catabolique met en action une amylophosphorylase. Elle libère, en présence de phosphore inorganique, du glucose 1-P et des dextrines limites. Elle a été trouvée chez la pomme de terre, le maïs, le pois sous forme de plusieurs isomères.L’inuline est un fructoholoside composé de 30-40 restes fructose. Hydrolysée par des inulases, cette chaîne se rompt au niveau des liaisons 2-1 en produisant exclusivement des fructoses à l’exception des terminaisons glucose de la molécule.L’inuline est condensée, à partir des sucres provenant des feuilles, dans les organes souterrains (topinambour, dahlia, chicorée) ou les réceptacles floraux (artichaut). Elle existe à l’état dissous dans les vacuoles où elle précipite par l’action d’alcool absolu sous forme de sphérocristaux, non colorables par l’iode et qui se déposent le long des parois cellulaires. Elle est présente chez les Composées, les Campanulacées, les Lobéliacées. Des substances apparentées à l’inuline se rencontrent chez les Liliacées, les Amaryllidacées, les Graminées (le nombre de restes est moindre).Les mannanes sont des polymères de résidus mannose liés en 1-4. Ils forment une chaîne sur laquelle sont attachés de loin en loin des galactoses: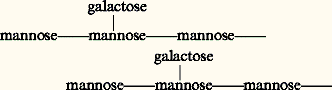 Les parois des cellules de l’albumen de nombreuses graines de Légumineuses (caroubier, fenugrec, luzerne) et de palmiers (Phytelephas macrocarpa = ivoire végétal et palmier dattier) s’épaississent considérablement à la suite de dépôts d’hémicelluloses.Les parois cellulaires du périsperme du café et des cotylédons de lupin en sont également imprégnées. Lorsque le galactose se substitue en partie au mannose, il se forme des galactomannanes (Légumineuses, Annonacées, Rubiacées). Le degré de «galactosylation» varie avec les espèces (20 p. 100 du poids sec chez la caroube). Très poussée, elle mène à des mucilages. Il existe également de nombreuses hémicelluloses caractérisées par les proportions relatives des différents oses qui les constituent: glucose, mannose, xylose, arabinose et aussi acides uroniques. Tous ces polysaccharides ont une grande capacité d’imbibition de l’eau.4. Contrôle de l’utilisation des réservesLa mobilisation des réserves est liée à la réhumidification des graines. Avec celle-ci s’instaure un métabolisme actif qui est révélé par une respiration intense et une synthèse de nouvelles protéines servant à la croissance de la jeune plantule. Ces phénomènes débutent avec l’intervention d’enzymes dont l’action est déclenchée par des commandes hormonales venant en général de l’embryon. Ils ont été étudiés surtout chez les céréales, dont les embryons ont l’avantage, détachés du reste de la graine, de poursuivre leur germination car contenant assez de matériaux dans le scutellum notamment. Ainsi son action sur la mobilisation des réserves de l’albumen peut être appréciée.Voici les principales étapes qui jalonnent la germination telles qu’elles ont été mises en évidence dans le caryopse d’orge (fig. 8).Un des premiers événements, dont la suite des événements ultérieurs dépend, est la synthèse d’acides gibberelliques, d’abord par l’axe embryonnaire, puis après 24 heures par le scutellum, cotylédon en forme de bouclier. Parallèlement, une autre hormone, l’acide indolacétique (auxine), est produite par le coléoptile de l’embryon. Elle assure la différenciation vasculaire nécessaire au transport des acides gibberelliques.L’acide gibberellique, transporté dans les cellules de la couche à aleurone, y induit la synthèse de novo d’hydrolases ( 見-amylase, protéase). Cependant, sa présence n’est pas nécessaire à la formation, dans la couche à aleurone, de la 廓 1.3. gluconase et autres enzymes ayant pour fonction de digérer les parois ; elles agissent ainsi sur les cellules à aleurone, ce qui facilite le passage des hydrolases vers l’albumen, puis sur les parois de l’albumen amylacé. Le rôle de l’acide gibberellique sur la production d’enzymes est révélé par l’application d’actinomycine D et de cycloheximide, substances qui inhibent la synthèse protéique, la première au niveau de la transcription, la seconde au niveau de la traduction des messagers sur les ribosomes.Si l’embryon est excisé, les cellules de l’albumen ne sont pas dégradées, ce qui prouve le contrôle de la production des enzymes de la couche à aleurone par l’acide gibberellique émis par l’embryon. En revanche, si on applique à des graines débarrassées de leur embryon des solutions diluées de cette hormone, les enzymes sont sécrétées.Après digestion des hémicelluloses des parois, les protéines sont transformées en acides aminés tandis que l’amidon est hydrolysé en sucres réducteurs puis en saccharose. Ces produits sont transportés dans l’axe fournissant ainsi les matériaux et l’énergie nécessaires à la première croissance des plantules.Des modifications cytologiques importantes sont visibles. Les parois de l’albumen sont digérées, lui-même se liquéfie puis disparaît, son contenu étant utilisé par l’embryon. La synthèse des protéines s’accompagne dans l’embryon de la multiplication des ribosomes, qui s’unissent à l’ARN messager pour donner des polysomes, et de la prolifération concommitante de réticulum endoplasmique granuleux.Les facteurs qui contrôlent la mobilisation des réserves dans les graines autres que les céréales sont moins bien connus. Dans les graines exalbuminées, par exemple celles de pois, les réserves de l’axe suffisent pour amorcer l’élongation de la radicule et les premiers remaniements internes. Mais très vite le développement de la plantule dépend des réserves nutritives des cotylédons. Les hydrates de carbone sont mobilisés sous l’action d’abord d’une amylophosphorylase puis d’amylases 見 et 廓. Le taux des protéines cotylédonaires baisse dès le premier jour de la germination, et cette tendance s’affirme les jours suivants sous l’effet de protéases. Une partie de ces enzymes serait formée de novo . L’axe commande ces divers phénomènes. Par exemple, l’hydrolyse des protéines n’a pas lieu si l’axe embryonnaire est retiré.Pour achever ce chapitre, il faut souligner que la mobilisation des réserves alimentaires ne peut se faire que si les dormances de la graine sont rompues. Les embryons de graines dormantes semblent incapables de produire l’acide gibberellique indispensable au déclenchement des processus d’utilisation des réserves. La synthèse de cet acide n’est possible que lorsque l’état de dormance a cessé, ce qui nécessite une post-maturation plus ou moins prolongée.
Les parois des cellules de l’albumen de nombreuses graines de Légumineuses (caroubier, fenugrec, luzerne) et de palmiers (Phytelephas macrocarpa = ivoire végétal et palmier dattier) s’épaississent considérablement à la suite de dépôts d’hémicelluloses.Les parois cellulaires du périsperme du café et des cotylédons de lupin en sont également imprégnées. Lorsque le galactose se substitue en partie au mannose, il se forme des galactomannanes (Légumineuses, Annonacées, Rubiacées). Le degré de «galactosylation» varie avec les espèces (20 p. 100 du poids sec chez la caroube). Très poussée, elle mène à des mucilages. Il existe également de nombreuses hémicelluloses caractérisées par les proportions relatives des différents oses qui les constituent: glucose, mannose, xylose, arabinose et aussi acides uroniques. Tous ces polysaccharides ont une grande capacité d’imbibition de l’eau.4. Contrôle de l’utilisation des réservesLa mobilisation des réserves est liée à la réhumidification des graines. Avec celle-ci s’instaure un métabolisme actif qui est révélé par une respiration intense et une synthèse de nouvelles protéines servant à la croissance de la jeune plantule. Ces phénomènes débutent avec l’intervention d’enzymes dont l’action est déclenchée par des commandes hormonales venant en général de l’embryon. Ils ont été étudiés surtout chez les céréales, dont les embryons ont l’avantage, détachés du reste de la graine, de poursuivre leur germination car contenant assez de matériaux dans le scutellum notamment. Ainsi son action sur la mobilisation des réserves de l’albumen peut être appréciée.Voici les principales étapes qui jalonnent la germination telles qu’elles ont été mises en évidence dans le caryopse d’orge (fig. 8).Un des premiers événements, dont la suite des événements ultérieurs dépend, est la synthèse d’acides gibberelliques, d’abord par l’axe embryonnaire, puis après 24 heures par le scutellum, cotylédon en forme de bouclier. Parallèlement, une autre hormone, l’acide indolacétique (auxine), est produite par le coléoptile de l’embryon. Elle assure la différenciation vasculaire nécessaire au transport des acides gibberelliques.L’acide gibberellique, transporté dans les cellules de la couche à aleurone, y induit la synthèse de novo d’hydrolases ( 見-amylase, protéase). Cependant, sa présence n’est pas nécessaire à la formation, dans la couche à aleurone, de la 廓 1.3. gluconase et autres enzymes ayant pour fonction de digérer les parois ; elles agissent ainsi sur les cellules à aleurone, ce qui facilite le passage des hydrolases vers l’albumen, puis sur les parois de l’albumen amylacé. Le rôle de l’acide gibberellique sur la production d’enzymes est révélé par l’application d’actinomycine D et de cycloheximide, substances qui inhibent la synthèse protéique, la première au niveau de la transcription, la seconde au niveau de la traduction des messagers sur les ribosomes.Si l’embryon est excisé, les cellules de l’albumen ne sont pas dégradées, ce qui prouve le contrôle de la production des enzymes de la couche à aleurone par l’acide gibberellique émis par l’embryon. En revanche, si on applique à des graines débarrassées de leur embryon des solutions diluées de cette hormone, les enzymes sont sécrétées.Après digestion des hémicelluloses des parois, les protéines sont transformées en acides aminés tandis que l’amidon est hydrolysé en sucres réducteurs puis en saccharose. Ces produits sont transportés dans l’axe fournissant ainsi les matériaux et l’énergie nécessaires à la première croissance des plantules.Des modifications cytologiques importantes sont visibles. Les parois de l’albumen sont digérées, lui-même se liquéfie puis disparaît, son contenu étant utilisé par l’embryon. La synthèse des protéines s’accompagne dans l’embryon de la multiplication des ribosomes, qui s’unissent à l’ARN messager pour donner des polysomes, et de la prolifération concommitante de réticulum endoplasmique granuleux.Les facteurs qui contrôlent la mobilisation des réserves dans les graines autres que les céréales sont moins bien connus. Dans les graines exalbuminées, par exemple celles de pois, les réserves de l’axe suffisent pour amorcer l’élongation de la radicule et les premiers remaniements internes. Mais très vite le développement de la plantule dépend des réserves nutritives des cotylédons. Les hydrates de carbone sont mobilisés sous l’action d’abord d’une amylophosphorylase puis d’amylases 見 et 廓. Le taux des protéines cotylédonaires baisse dès le premier jour de la germination, et cette tendance s’affirme les jours suivants sous l’effet de protéases. Une partie de ces enzymes serait formée de novo . L’axe commande ces divers phénomènes. Par exemple, l’hydrolyse des protéines n’a pas lieu si l’axe embryonnaire est retiré.Pour achever ce chapitre, il faut souligner que la mobilisation des réserves alimentaires ne peut se faire que si les dormances de la graine sont rompues. Les embryons de graines dormantes semblent incapables de produire l’acide gibberellique indispensable au déclenchement des processus d’utilisation des réserves. La synthèse de cet acide n’est possible que lorsque l’état de dormance a cessé, ce qui nécessite une post-maturation plus ou moins prolongée.
Encyclopédie Universelle. 2012.
